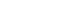ඖෂධ සඳහා අලෙවිකරණ අවසරය ලබා ගැනීමේ ක්රියා පටිපාටිය
පියවර 1 - ඖෂධ ලියාපදිංචි කිරීම සඳහා නව නිෂ්පාදකයාගේ අනුමැතිය
නිෂ්පාදන අඩවියේ අනුමැතිය සඳහා ඉල්ලුම් පත්රයක් ඉදිරිපත් කළ යුතුය. නිෂ්පාදකයා විදේශ රටක නම්, නිෂ්පාදකයා නියෝජනය කිරීමට බලයලත් දේශීය සමාගමක් පත් කළ යුතු අතර සියලු අයදුම්පත් ඉහත කී දේශීය නියෝජිතයා හරහා ඉදිරිපත් කළ යුතුය.
නිෂ්පාදන භූමියේ අනුමැතිය ලැබීමෙන් පසු අදාළ නිෂ්පාදකයා විසින් නිෂ්පාදනය කරනු ලබන ඖෂධ ලියාපදිංචි කිරීම සඳහා අයදුම්පතක් ඉදිරිපත් කළ යුතුය.
පියවර 2 - ඖෂධ ලියාපදිංචි කිරීම
අයදුම් පතක් වර්ග: අනුමැතිය සඳහා අයදුම්පත් ඉදිරිපත් කිරීම සඳහා ඖෂධ පුළුල් උප බෙදීම් ලෙස පහත දැක්වෙන කාණ්ඩවලට බෙදා ඇත
නව අණුක සංයුතීන් (NME)
ශ්රී ලංකාවේ මීට පෙර ලියාපදිංචි කර නොමැති රසායනිකයක් ක්රියාකාරී සංයෝගයක ලවණයක්, කලින් අනුමත කරන ලද රසායනිකයක එස්ටරයක් හෝ සංකීර්ණයක්
නව මාත්රා ආකෘති (NDF)
දැනට ශ්රී ලංකාවේ ලියාපදිංචි ඖෂධයක ආකෘති පත්ර හැරුණු විට වෙනත් ඕනෑම භෞතික ආකාරයක්
නව සංයෝජන නිෂ්පාදන (NCP)
නව සංයෝජන නිෂ්පාදනයක් යනු මීට පෙර ශ්රී ලංකාවේ ලියාපදිංචි කර නොමැති තනි මාත්රාවකින් ඖෂධ දෙකක් හෝ වැඩි ගණනක් සකස් කිරීමයි.
නව නිෂ්පාදන (එන්පී)
ශ්රී ලංකාවේ දැනටමත් ලියාපදිංචි ඖෂධයේ ඕනෑම නව නිෂ්පාදනයක්
ජීව නිෂ්පාදන
එන්නත් සහ සේරා (පුද්ගලික අංශයේ එන්නත් හැසිරවීම හා ගබඩා කිරීම සඳහා මාර්ගෝපදේශ)(Guidelines for Handling and Storage of Vaccines in the Private Sector)
ප්ලාස්මා නිෂ්පාදන
ජෛව තාක්ෂණික නිෂ්පාදන
අනෙකුත් ජීව විද්යාත්මක නිෂ්පාදන
අලෙවිකරණ බලය පවරන්නා වන (එනම් දේශීය නිෂ්පාදකයා හෝ නිෂ්පාදකයා නියෝජනය කරන දේශීය ආනයනකරු) ඖෂධ සාම්පල සමඟ සීඩීඩී රෙගුලාසි වල 4 වන උපලේඛනයේ දක්වා ඇති ආකෘතියට අයදුම්පතක් (අවශ්ය ලියකියවිලි) ජාතික ඖෂධ නියාමන අධිකාරියට ඉදිරිපත් කළ යුතුය . ජාතික ඖෂධ නියාමන අධිකාරියට අයදුම්පත ඉදිරිපත් කිරීමට පෙර, ලියාපදිංචි සාම්පල ආනයනය කිරීමේදී රේගු නිෂ්කාශනය පහසු කිරීම සඳහා නියැදි බලපත්රයක් ජාතික ඖෂධ නියාමන අධිකාරිය වෙතින් ලබා ගත යුතුය.
සමාන ජෛව චිකිත්සක නිෂ්පාදන ඇගයීම පිළිබඳ මාර්ගෝපදේශ (එස්බීපී)
නියැදි ආනයන බලපත්රය ලබා ගැනීම
ඖෂධ අලෙවිකරණ අවසරය සඳහා ඉල්ලුම්කරුවෙකු, ශ්රී ලංකාවේ අලෙවිකරණය කිරීමට අදහස් කරන වාණිජ ඇසුරුම්වල අවම වශයෙන් ඇසුරුම් දෙකක් සහ අලෙවිකරණ අවසරය සඳහා වන අයදුම්පත ඉදිරිපත් කළ යුතුය. නිෂ්පාදකයා විදේශයක සිට නම්, එවැනි ලියාපදිංචි සාම්පල ආනයනය කිරීමේදී රේගු නිෂ්කාශනය පහසු කිරීම සඳහා ජාතික ඖෂධ නියාමන අධිකාරිය වෙතින් නියැදි බලපත්රයක් අවශ්ය වේ.
ලියාපදිංචි සාම්පල ආනයනය කිරීම සඳහා අයදුම්පත (XI උපලේඛනය) සමඟ පහත සඳහන් ලේඛන අයදුම්කරු විසින් ඉදිරිපත් කළ යුතුය.
- ඉල්ලුම්කරු විසින් නියැදි බලපත්රයක් සඳහා ඉල්ලීම් පත
- අයදුම්කරු තම දේශීය නියෝජිතයා ලෙස සඳහන් කරමින් නිෂ්පාදකයා විසින් බලය පවරන ලද ලිපිය
- ජාතික ඖෂධ නියාමන අධිකාරිය විසින් නිෂ්පාදන අඩවිය සඳහා අනුමත කිරීමේ ලිපිය (CP අනුමත ලිපිය)
කිසියම් නිෂ්පාදනයක් සඳහා නියැදි බලපත්රයක් නිකුත් කිරීම ප්රතික්ෂේප කිරීමේ අයිතිය ඖෂධ නියාමන අධිකාරිය සතුය. අදාළ අයිතමයේ ලියාපදිංචි නිෂ්පාදන විස්සක් හෝ වැඩි ගණනක් තිබේ නම් දැනට ඖෂධ නියාමන අධිකාරිය අයදුම්පත් භාර නොගනී.
අයදුම්කරු නියැදි බලපත්රය ලබා ගත් පසු, ඔහු අදාළ රෙගුලාසි වල දක්වා ඇති බලපත්රයේ කොන්දේසිය පිළිපැදිය යුතුය. විශේෂයෙන්, අයදුම්කරු එවැනි නියැදි බලපත්ර මත ආනයනය කරන ලද භාණ්ඩ සම්බන්ධ සියලු වාර්තා පවත්වා ගත යුතුය.
ලියාපදිංචි සාම්පල ආනයනය කිරීම
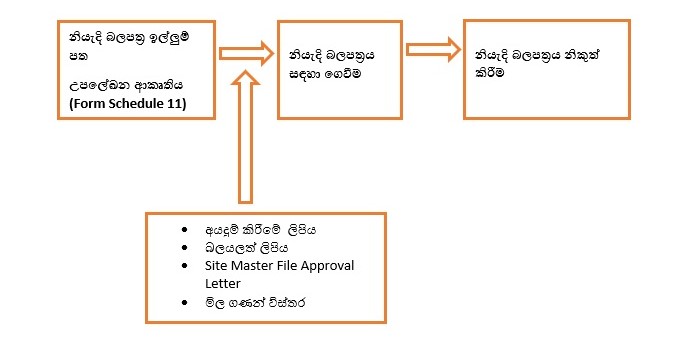
Submission of Registration Application
Figure 1: Registration of NP Applications
ලියාපදිංචි කිරීමේ සහතිකය වසර 5 ක් සඳහා වලංගු වේ. විශේෂිත තත්වයන් යටතේ (උදා: ඖෂධය නව රසායනික සංයුතියක් වන විට, නිෂ්පාදකයා මේ රටට නවකයෙක් වේ නම් ) තාවකාලික ලියාපදිංචියක් පළමුව නිකුත් කරනු ලැබේ, එය වසර එකක් හෝ දෙකක් සඳහා වලංගු වේ.
පවත්නා ලියාපදිංචිය කල් ඉකුත්වීමට මාස 6 කට පෙර IV වන ආකෘති පත්රයේ අළුත් කිරීමේ අයදුම්පතක් සහ අවශ්ය අනෙකුත් ලියකියවිලි ඉදිරිපත් කළ යුතුය.
ලියාපදිංචි ඖෂධයේ කිසියම් වෙනස්කමක් (විචලනය) ජාතික ඖෂධ නියාමන අධිකාරියට දැනුම් දිය යුතුය. එන්එම්ඊ, එන්ඩීඑෆ්, එන්සීපී
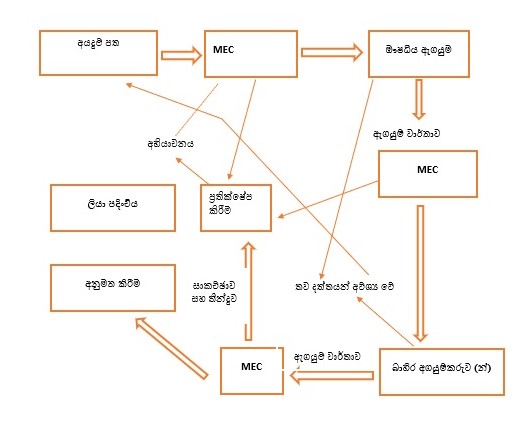
රූපය 2 : එන්එම්ඊ, එන්ඩීඑෆ් සහ නව රසායනික සංයුතීන්, නව මාත්රා ස්වභාව හා නව නිෂ්පාදිත එන්සීපී ලියාපදිංචි කිරීම